La materia.
La electricidad se define como un movimiento de electrones por el interior de un conductor eléctrico.
Este concepto tan claro hoy en día, en nuestros orígenes se tenía que observar mediante los efectos que provocaba en las tormentas o en las propiedades de algunos cuerpos que se cargaban estáticamente respecto a otros cuerpos.
Poco a poco se fue avanzando en el estudio de la electricidad y se llegó a la conclusión de que la electricidad, no la formaban las tormentas ni los cuerpos cargados eléctricamente, sino que la electricidad era un fenómeno creado por la diferencia de potencial eléctrica de los cuerpos afectados por la electricidad.
Entonces se comenzó a pensar en un nuevo concepto. La materia. Ésta, produce la electricidad cuando existe una diferencia de carga eléctrica en ella. Pero ¿cómo produce la materia un cambio de estado eléctrico?, ¿cuál es la causa que produce este cambio? Y lo más importante, ¿cómo podemos hacer que esta electricidad se pueda usar para otros fines?
Mucho se ha avanzado en el estudio del átomo desde su descubrimiento en el siglo diecinueve.
Mucho antes, los antiguos científicos griegos se postularon e investigaron sobre esta partícula que es la base sobre la que se estructura la materia.
Este primer tema te acercará a la descripción que se tiene de la materia y de los elementos que la componen. Que como puedes ya saber, cada elemento forma un compuesto y ese compuesto se agrupa en cuerpos y estos, son los que representan a la materia en su magnificencia.
Pero fundamentalmente estudiaremos los inicios en el estudio del átomo y como los grandes científicos en este ámbito tecnológico estudiaron para conseguir descifrar el código cuántico del átomo.
La materia.
Físicamente consideramos como materia todo lo que podemos ver, tocar o percibir de alguna manera o ocupa un lugar en el espacio; así la mesa de nuestro escritorio, el azúcar de nuestro café, el cemento, el agua, e incluso el olor de las flores, son materia o por decirlo de alguna manera son partes de materia.
La materia se nos presenta en porciones limitada como apreciamos cuando miramos una piedra, un trozo de madera o una parte del cielo del atardecer; a estas partes se las denominan CUERPOS.
Piensa que un mineral de Granito presenta varios minerales juntos que le dan forma al mineral como por ejemplo el Cuarzo, la Mica o Feldespato entre otros. La materia en sí misma tiene diversas formas, olores y colores y se agrupa en elementos básicos que se unen para obtener diversos materiales, orgánicos o inorgánicos. La materia se puede medir, es perceptible por los seres vivos y conlleva una cierta energía que se puede manifestar en cualquier condición física o química.
La materia la vemos en una gran variedad de formas y aspectos, a los que designaremos como distinguiendo en ella tres condiciones o “cuerpos”; y los clasificamos en cuatro estados principales:
- sólido
- líquido
- gaseoso
- plasma
El cuerpo SÓLIDO es el que tiene forma y volumen propios: el hierro, la madera, la arena, el cemento, y un gran número de cuerpos sólidos.

La caracteristica principal de los sólidos es que ofrecen resistencia a cambios de forma y volumen, ya que sus partículas se encuentran muy juntas y correctamente ordenadas, lo cual le da una gran cohesión y forma definida.
Cuerpo LÍQUIDO es el que tiene volumen propio pero no forma, adaptando la del recipiente que lo contiene: el agua, el vino, refrescos varios, cualquier líquido por general.

Hay que decir que existen líquidos que a pesar de que se consideren un líquido, poseen una viscosidad que lo hace asimilarse a un sólido.
Cuerpo GASEOSO es el que no tiene ni forma ni volumen propio, ocupando en su totalidad el recipiente que lo contiene: el aire, el oxígeno o hidrógeno son algunos ejemplos.
Existe un último estado de la materia que se llama PLASMA. El cuerpo plasma se caracteriza en que está cargado eléctricamente y posee un estado similar al gaseoso y es un estado de los cuerpos gaseosos a altas temperaturas y presiones.
La materia se agrupa en estos estados de la materia dependiendo del estado de agitación de sus átomos es decir, la energía que posean en el momento.
Propiedades de la materia.
Cuando hablamos de sustancias, estamos hablando de porciones de materia.
Una mesa está formada por la materia de la madera, y a su vez, la madera es la unión de varias porciones de otros tipos de materia que la forman.
Existen dos tipos de sustancias generalizadas: las sustancias simples y las sustancias compuestas.
SUSTANCIAS SIMPLES.
Son las que están formadas por una sola clase de materia, como el oro, el hidrógeno, el hierro, etc. se conocen 118 elementos puros.
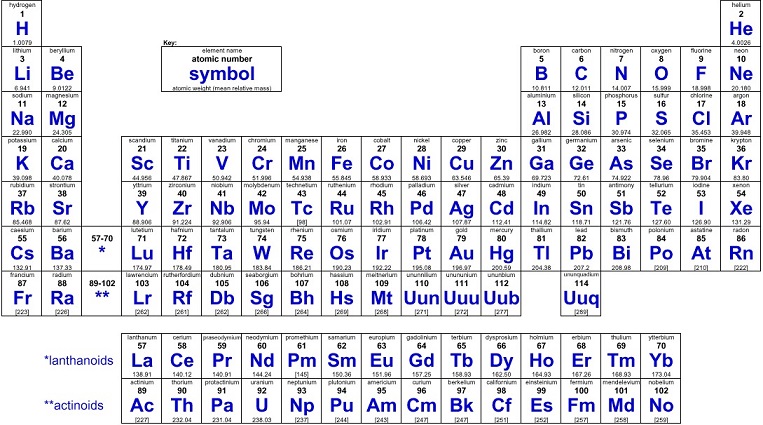
SUSTANCIAS COMPUESTAS.
Son las que están formadas por dos o más sustancias simples.
Por lo general siempre son más de dos compuestos los que forman la materia compuesta.
OJO: Dos sustancias simples que se unan, forman un cuerpo de esa materia simple y no forman un cuerpo de materia compuesta.
Para que tengas una idea más exacta de la materia, explicaremos brevemente las propiedades de la materia.
La materia tiene peso porque ejerce presión sobre la superficie en que se halla asentada, requiriendo una fuerza para desplazarla de su sitio.
Es evidente que un mismo sitio no puede ser ocupado simultáneamente por dos cuerpos, siendo esta propiedad impenetrabilidad.
Todos los cuerpos son más o menos porosos, es decir tiene huecos o espacios vacíos. Esta propiedad se llama porosidad.
Un cuerpo o materia puede dividirse en trozos cada vez más pequeñas, propiedad que se denomina divisibilidad.
Según la ley de la gravitación universal de Newton, todos los cuerpos persisten en estado de reposo o movimiento mientras no actúe sobre ellos alguna fuerza que le obligue a cambiar de estado. Esta propiedad se llama inercia.
Aplicando una fuerza a un cuerpo este tiende a vibrar e incluso se puede deformar por su elasticidad.
Si cambia de forma, pero no de volumen entonces presenta la rigidez.
Según las leyes de la química, no pueden alterarse la cantidad de materia, es decir, de masa o sustancias; dicha propiedad se conoce con el nombre de indestructibilidad.
Constitución de la materia
La mayor parte de las cuestiones mencionadas hasta aquí son más o menos conocidas por todas las personas, por tratarse se cosas que se observan habitualmente.
Gracias a las últimas tecnologías y al desarrollo de instrumentos de observación científicos, se ha podido observar cómo está formada la materia y qué la forma.
La materia es un conjunto de sustancias, del tipo que sean, que se han unido para formar una estructura química en un estado concreto.
Imagina un trozo de carbón. Si con una herramienta física lo rompemos, y la hacemos trozos cada vez más y más pequeños, al final, el carbón, después de largo tiempo, quedará reducida a un fino polvo negruzco.
De ese polvo, la parte más básica (la que está formada por los componentes del carbón) es la molécula.
Entre las propiedades de la materia hemos citado la divisibilidad; la materia se puede dividir hasta llegar a convertirla en unidades inseparables físicamente, tan pequeñas que sea el medio físico que sea, no se puede separar mas unas de otras. Por poner otro ejemplo más entendible, cogemos un cuadrado de azúcar para nuestra explicación.

Golpeando el cubo de azúcar, lo destrozamos y dejamos el azúcar en granos similares a la arena. Se pueden apreciar los granos que la forman y después, siguiendo machacando los granos de azúcar hasta que este se convierte en un polvo impalpable.
Ahora bien cada uno de esos granos de polvo, aparentemente impalpable, no llegan a ser la parte más pequeña de la materia, por lo que podría seguir siendo divisible si dispusiéramos de medios para ello.
De este modo llegamos a la menor partícula estable posible a la que puede reducirse la materia. A esta partícula mínima se la llama molécula. La molécula es por tanto la menor porción de materia compuesta, que no se descompone más por sí sola.
Resulta que la molécula no es el elemento más pequeño, ya que a su vez está constituida por una agrupación de otras entidades de materia aún menores. Estas agrupaciones se llaman átomos, que son unidades fundamentales de materia y que asignan las propiedades físicas de la estructura de la materia.
El átomo.
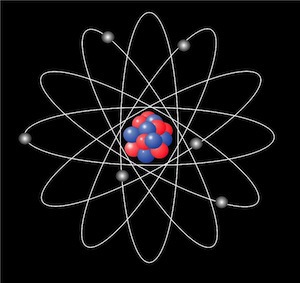
El átomo (palabra derivada del griego ἄτομον y que significa “no divisible”) es una partícula fundamental de la materia.
En nuestro último ejemplo, cuando sigues rompiendo el azúcar y obtienes moléculas de azúcar, si con otro medio químico siguiéramos dividiendo la molécula, obtendríamos la masa más pequeña e indivisible por cualquier medio químico.
Esa parte de la materia es la parte de la cual se compone toda la materia, todo lo que puedes ver o sentir, está formado por una agrupación de átomos en diversas estructuras químicas.
El átomo es la porción más pequeña de una sustancia simple. Ahora bien, el átomo tampoco es una masa sólida y única, sino que está formado por un conglomerado de diversas clases de corpúsculos mucho más pequeños que el propio átomo.
Un átomo no se puede obtener físicamente mediante la descomposición física de la materia sino con otros medios tecnológicos.
Estructura planetaria
En 1911, el físico Lord Rutherford expuso su teoría de que el átomo era un sistema "micro solar".

Este físico fue el descubridor del núcleo atómico al bombardear una placa de mica con una serie de partículas alfas (átomos de Helio).
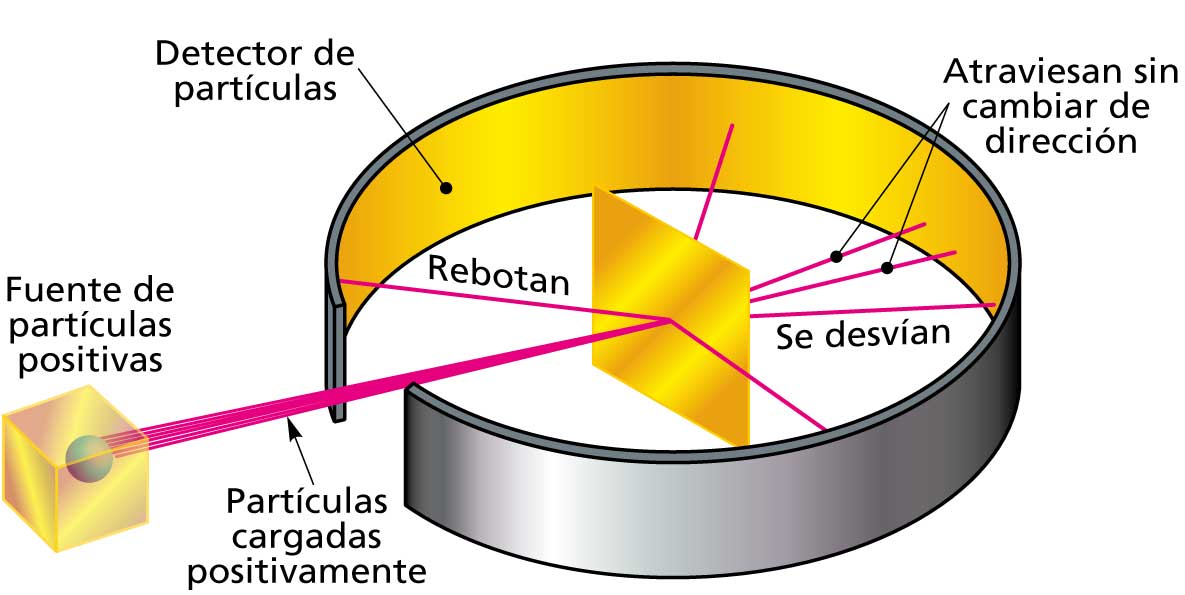
Estas partículas, se desviaban hasta noventa grados al atravesar la placa de Mica lo que indicaba que los átomos de la placa, deberían de estar formados por un núcleo atómico que formara la mayor parte del átomo.
Estos núcleos atómicos de la Mica, chocarían con los núcleos atómicos de las partículas alfa liberando cantidades de electrones, que son las partículas que giran alrededor del núcleo atómico.
De ahí estableció que al igual que el Sol, el núcleo está rodeado por partículas infinitamente pequeñas girando alrededor del núcleo en diferentes orbitas a las que llamó orbitales.
En el núcleo hay protones, que son partículas cargadas eléctricamente positivas, y neutrones, que son partículas con masa pero sin carga eléctrica. Estos últimos llevan el peso del átomo al darle masa.
Las pequeñas partículas que giran en orbitas alrededor del núcleo, son los electrones, que tienen carga negativa y una masa equivalente a la del protón.
A partir del estudio de estas subpartículas y, siguiendo bombardeando átomos de diferentes elementos, se describieron nuevas subpartículas que proceden del núcleo atómico como por ejemplo el Quark.
Las partículas que más nos interesan para el estudio de este curso son los electrones ya que la definición exacta de electricidad es el paso de electrones a través de un conductor.
Un átomo puede ser de cualquier tipo de materia y se puede combinar con cualquier otro tipo de átomo de cualquier otro tipo de materia, siempre y cuando se den las condiciones necesarias para la unión.
En el dibujo anterior observamos un átomo de carbono con 6 protones, 7 neutrones, en el núcleo, y 6 electrones girando a su alrededor en orbitas diferentes.
No me voy a explayar en la explicación de la física cuántica, pero os hablaré de lo básico para comprender la naturaleza eléctrica:
Las cargas de los protones y los electrones neutraliza eléctricamente al átomo (cargas positivas y negativas se neutralizan); ese estado de neutralidad no se mantiene por mucho tiempo debido a las fuerzas de atracción y repulsión, fuerzas magnéticas, fuerzas mecánicas y otras energías, hacen que el átomo pierda o gane electrones. ¿Como puede perder o ganar electrones y mantener la estructura básica de la materia? Ten en cuenta que muchas veces te expones a calambrazos o chispazos por la corriente estática que proporcionan algunos cuerpos. Estos fenómenos se deben a su exclusividad de que los átomos pierden y ganan electrones constantemente.
Valencia y molécula.
El átomo intenta ganar la estabilidad química por medio del control reciproco de sus cargas eléctricas positivas y negativas. Para ello cuando se le aplica energía, el átomo cede electrones, pero solo los suficientes para alcanzar la estabilidad, y solo cuando la energía aplicada no sea superior para romper el enlace atómico. Observemos de nuevo el dibujo:
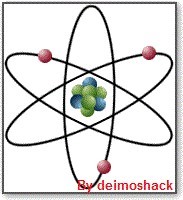
El átomo de Litio tiene 3 electrones. Si le aplicáramos calor, cedería 1 electrón que sería el que está más alejado del núcleo. Por tanto necesita menos energía para abandonar su órbita.
Los electrones se agrupan en orbitas alrededor del núcleo en proporción a una formula química que en este curso no interesa conocer.
Simplemente debe saber que para saber cuántos electrones caben cada orbita debes aplicar la formula 2 x N2. Siendo N, el número de capas o orbitas que tiene el átomo.
Así, por ejemplo en la primera orbina caben 2 x 12 electrones = 2.
En la siguiente, 2 x 22 electrones = 8.
Y así sucesivamente.
La órbita de valencia se considera la órbita que necesita estabilizar el átomo para que este se encuentre químicamente estable, y en la realidad no caben más de 8 electrones en la capa de valencia.
Deduciendo en la forma anterior, el único elemento que tiene 8 electrones en su órbita de valencia es el Neón con 10 electrones (orbita 1=2 electrones, orbita 2=8 electrones) ¿cómo es posible esto? ¿El único elemento estable químicamente es el Neón?
Todo esto es posible ya que las orbitas del átomo se divide en orbitales, por lo que en el último orbital habitado por electrones hay entre 0 y 8 electrones. El número de electrones de este ultimo orbital (capa de valencia) determina las propiedades físicas, químicas y estructurales de los átomos.
Volviendo al tema, cuando un átomo pierde o gana electrones, se convierte en un ión. Un ión es un átomo que ha pasado de ser neutro eléctricamente a tener una carga eléctrica dependiendo de que haya perdido uno o más electrones (ión positivo), al prevalecer la carga positiva; o ganado uno o más electrones (ión negativo), al prevalecer las cargas negativas.